Anisocoria as a side effect of paclitaxel treatment
Halámková J.1, Adámková Krákorová D.1, Demlová R.2,3
1 Klinika komplexní onkologické péče LF MU a MOÚ, Brno
2 Farmakologický ústav, LF MU Brno
3 Oddělení klinického hodnocení, MOÚ Brno
Klin Onkol 2021; 34(4): 306–308. doi: 10.48095/ccko2021306
Souhrn
Východiska: Paklitaxel patří k nejrozšířenějším cytostatikům užívaným v onkologii, je součástí terapeutických protokolů větší části malignit. Jedním z jeho nejčastějších nežádoucích účinků je periferní neuropatie. Tato symptomatologie často vede ke snížení dávkové intenzity chemoterapeutických léků či předčasnému ukončení léčby. Případ: V naší kazuistice popisujeme vzácný případ anizokorie způsobené paklitaxelem u mladé ženy s karcinomem prsu. Závěr: Oční nežádoucí účinky související s taxany jsou vzácné, s odhadovanou frekvencí kolem 1 %; kromě poměrně časté obstrukce nazolakrimálního vývodu je kazuisticky popisován cystoidní makulární edém či ischemická retinopatie. Ve většině případů očních nežádoucích účinků terapie paklitaxelem však není třeba redukovat či ukončovat onkologickou terapii. Nutná je však spolupráce onkologa se zkušeným a poučeným oftalmologem.
Summary
Background: Paclitaxel is one of the most common cytostatics used in oncology; it is part of the therapeutic protocols of many malignancies. One of its most common side effects is peripheral neuropathy. This symptomatology often leads to a reduction in the dose intensity of chemotherapeutic drugs or to early discontinuation of the treatment. Case: In our case report, we describe a rare case of paclitaxel-induced anisocoria in a young woman with breast cancer. Conclusion: Ocular side effects related to taxanes are rare, with an estimated frequency of about 1%. In addition to relatively frequent obstruction of the nasolacrimal duct, the cystoid macular edema or ischemic retinopathy have been reported. However, in most cases paclitaxel-induced ocular side effects, there is no need to reduce or discontinue therapy. However, the collaboration of an oncologist with an experienced and trained ophthalmologist is essential.
Úvod
Paklitaxel patří k nejrozšířenějším cytostatikům užívaným v onkologii, je součástí terapeutických protokolů velké části malignit. Jeho antineoplastický efekt je způsoben vazbou na ß-tubulinovou podjednotku mikrotubulu, což podporuje shlukování mikrotubulů z tubulinových dimerů a stabilizuje mikrotubuly tím, že brání depolymerizaci a vede k zástavě mitózy [1]. Jedním z jeho nejčastějších nežádoucích účinků je periferní neuropatie. Periferní neuropatie indukovaná chemoterapií (chemotherapy-induced peripheral neuropathy – CIPN) je závažný a běžně pozorovaný nežádoucí účinek u pacientů léčených chemoterapeutiky. Protože paklitaxel nepřekračuje hematoencefalickou bariéru, ovlivňuje specificky periferní systém a vede k převážně senzorické axonální neuropatii. Ve valné většině jsou jejími projevy periferní parestezie či dysestezie, vzácně se projevuje jinou klinickou symptomatologií. Pacienti s CIPN mají sníženou kvalitu života a zhoršení fyzických schopností. Projevy CIPN často vedou ke snížení dávkové intenzity chemoterapeutických léků či předčasnému ukončení léčby. CIPN postihuje 48–90 % pacientů léčených paklitaxelem [2–4]. Toto široké rozmezí je pravděpodobně odrazem nejen rozdílů ve studovaných populacích a faktorů souvisejících s vlastními léčivy (např. intenzita dávky), ale také genetické predispozice. Periferní neuropatie způsobená taxany je vyvolána narušením mikrotubulů, což zhoršuje axonální transport a vede k wallerianské degeneraci, změněné aktivitě iontových kanálů a hyperexcitabilitě periferních neuronů. Taxanem indukované mitochondriální poškození přispívá ke zvýšené produkci reaktivních forem kyslíku (ROS – reaktivní kyslíkové radikály), což vede k poškození enzymů, proteinů a lipidů a k dysregulaci homeostázy vápníku v neuronech, to vyvolává apoptotické změny a demyelinaci periferních nervů. Aktivace mikroglií a astrocytů taxany vede k aktivaci imunitních buněk a k uvolňování a zvyšování prozánětlivých cytokinů. To má za následek senzibilizaci nociceptorů a opětovnou hyperexcitabilitu periferních neuronů, což vede k rozvoji neurozánětu [5]. I přes toto poznání zůstávají mechanizmy, které jsou základem CIPN, do značné míry nejasné a léčba tohoto stavu je pouze symptomatická.
Kazuistika
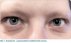
U mladé ženy, ročník narození 1986, která se dosud s ničím neléčila, byl v listopadu roku 2019 diagnostikován invazivní duktální karcinom levého prsu grade 3, s negativitou hormonálních receptorů i HER2, Ki 67 67 %, pT1c pN1a (1/7) M0 L1 V0 Pn0. Pacientka absolvovala parciální mastektomii levého prsu s disekcí axily mimo Masarykův onkologický ústav, následně byla odeslána k zahájení adjuvantní chemoterapie, absolvovala 4 cykly chemoterapie antracyklinem v kombinaci s cyklofosfamidem v dávkově-denzním režimu a následně chemoterapii paklitaxelem v dávce 80 mg/m2 1× týdně. Po sedmé aplikaci si začala všímat nesouměrné velikosti zornic, následné vyšetření prokázalo anizokorii, a to rozšíření levé zornice, dle oftalmologa až o 1 mm (obr. 1). Pacientka zcela negovala jakékoliv oční obtíže, ani při oftalmologickém vyšetření nebyl zjištěn žádný zásadní patologický nález, stejně jako při neurologickém vyšetření a magnetické rezonanci mozku. Vzhledem k jinak asymptomatickému průběhu jsme po dohodě s pacientkou nadále pokračovali v zavedené chemoterapii paklitaxelem. Anizokorie se sice více neprohlubovala, ale nedocházelo ani k její úpravě. Chemoterapii paklitaxelem pacientka dokončila v předpokládaném termínu bez redukce dávky. Následně pokračovala v adjuvantní radioterapii na oblast levého prsu a svodnou lymfatickou oblast (III.–IV. etáž) v dávce 25 × 2,0 Gy/50 Gy s boostem lůžka tumoru 8 × 2,0 Gy/16 Gy s minimálními nežádoucími účinky v podobě kožní toxicity. Anizokorie i po více než půl roce od ukončení terapie trvá, pro pacientku však nemá zásadní dopad na vizus, reakce zornic je zcela adekvátní, nadále však zůstává v péči očního lékaře. Zajímavostí jistě je, že se u ní po celou dobu léčby ani následně neprojevila tak častá periferní polyneuropatie končetin.
Diskuze
Očním příznakům je v rámci nežádoucích účinků léčby cytostatiky věnována malá pozornost. Většinově je tato symptomatologie zvládnutelná pouze lokální terapií a často není třeba redukovat či ukončovat onkologickou terapii. Při léčbě paklitaxelem byly popsány poruchy zrakového nervu, makulární edém, fotopsie či zakalení sklivce [6]. V roce 2020 byla publikována dosud jediná velká analýza očních nežádoucích účinků vzniklých po aplikaci taxanů. Celkem se jednalo o soubor 1 918 pacientů léčených taxany, z toho pouze 22 nemocných, tedy 1,1 %, mělo oční nežádoucí účinky. Nejčastěji se jednalo o dysfunkci meibomských žláz u 5 nemocných (23 %), následovanou makulárním edémem u 4 pacientů (18 %) a kanalikulární obstrukcí u 4 nemocných (18 %), diplopie byla pozorována ve 2 případech (9 %), anizokorie pak u 1 nemocného, další z popsaných očních nežádoucích účinků nebyly klinicky významné. Oční vedlejší účinky byly vyřešeny nebo kontrolovány bez přerušení léčby u 80 % pacientů. Většina závažných příznaků se po ukončení terapie upravila. Kromě poměrně časté obstrukce nazolakrimálního vývodu se však literatura o očních vedlejších účincích omezuje především na kazuistiky, z nichž je nejčastěji popisován cystoidní makulární edém, byla však popsána i ischemická retinopatie [7–10].
Závěr
Oční nežádoucí účinky související s taxany jsou vzácné, s odhadovanou frekvencí 1 %. Většina očních příhod může být dobře kontrolována lokální terapií bez přerušení léčby taxany. Ani tak závažné symptomatologie, kterou je anizokorie, se po vyloučení oční či intracerebrální patologie není třeba obávat a je možno plánovanou systémovou terapii paklitaxelem dokončit bez úprav dávky v celém rozsahu. Nutná je však spolupráce onkologa se zkušeným a poučeným oftalmologem.
MUDr. Jana Halámková, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: jana.halamkova@mou.cz
Obdrženo/Submitted: 19. 2. 2021
Přijato/Accepted: 15. 4. 2021
Literatura
1. Weaver BA. How Taxol/paclitaxel kills cancer cells. Mol Biol Cell 2014; 25(18): 2677–2681. doi: 10.1091/mbc.E14-04-0916.
2. Reyes-Gibby CC, Morrow PK, Buzdar A et al. Chemotherapy-induced peripheral neuropathy as a predictor of neuropathic pain in breast cancer patients previously treated with paclitaxel. J Pain 2009; 10(11): 1146–1150. doi: 10.1016/j.jpain.2009.04.006.
3. Seretny M, Currie GL, Sena ES et al. Incidence, prevalence, and predictors of chemotherapy-induced peripheral neuropathy: a systematic review and meta-analysis. Pain 2014; 155(12): 2461–2470. doi: 10.1016/j.pain.2014.09.020.
4. Martinez JW, Sanchez-Naranjo JC, Londono-De Los Rios PA et al. Prevalence of peripheral neuropathy associated with chemotherapy in four oncology centers of Colombia. Rev Neurol 2019; 69(3): 94–98. doi: 10.33588/rn.6903.2019035.
5. Zajączkowska R, Kocot-Kępska M, Leppert W et al. Mechanisms of chemotherapy-induced peripheral neuropathy. Int J Mol Sci 2019; 20(6): 1451. doi: 10.3390/ijms20061451.
6. SPC Taxol. [online]. Dostupné z: https: //www.sukl.cz/modules/medication/detail.php?code=0076204 &tab=texts.
7. Fortes BH, Liou H, Dalvin LA. Ophthalmic adverse effects of taxanes: the Mayo Clinic experience. Eur J Ophthalmol 2020. [In press]. Doi: 10.1177/1120672120969045.
8. Tanaka Y, Bando H, Hara H et al. Cystoid macular edema induced by nab-paclitaxel. Breast Cancer 2015; 22(3): 324–326. doi: 10.1007/s12282-012-0373-y.
9. Smith SV, Benz MS, Brown DM. Cystoid macular edema secondary to albumin-bound paclitaxel therapy. Arch Ophthalmol 2008; 126: 1605–1606. doi: 10.1001/archopht.126.11.1605.
10. Das A, Ranjan R, Shah PK et al. Paclitaxel- and/or cyclophosphamide-induced severe 10. ischaemic retinopathy. Clin Exp Ophthalmol 2020; 48(8): 1113–1115. doi: 10.1111/ceo.13854.
Článek byl uveřejněn s laskavým svolením redakce Klinické onkologie.
www.klinickaonkologie.cz